Equilíbrio Molecular ou Equilíbrio Químico
Lista de 10 exercícios de Química com gabarito sobre o tema Equilíbrio Molecular ou Equilíbrio Químico com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Equilíbrio Molecular ou Equilíbrio Químico.
1. (UFRS) Uma reação química atinge o equilíbrio químico quando:
- ocorre simultaneamente nos sentidos direto e inverso.
- as velocidades das reações direta e inversa são iguais.
- os reatantes são totalmente consumidos.
- a temperatura do sistema é igual à do ambiente.
- a razão entre as concentrações de reatantes e produtos é unitária.
2. (ITA) Seja o equilíbrio: H2(g) + I2(g) ⇄ 2 HI(g) KC = 50 à 500°C.
Olhando a reação um aluno faz três afirmações:
I. É impossível obter 2 moles de HI pela mistura de 1 mol de H2 com 1 mol de I2 a 500°C.
II. Reagentes e produtos formam um sistema heterogêneo.
III. É impossível conservar HI puro a 500°C.
- somente I é correta
- somente II é correta
- somente III é correta
- I e II são corretas
- I e III são corretas
3. (FATEC) Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma:
- xícara de café bem quente;
- garrafa de água mineral gasosa fechada;
- chama uniforme de bico de Bunsen;
- porção de água fervendo em temperatura constante;
- tigela contendo feijão cozido.
04. (USP) Dada a seguinte reação: A2 + 3 B2 D 2 AB3, verificou-se no equilíbrio a 1 000°C, que as concentrações em moles por litro são:
[A2] = 0,20 [B2] = 0,20 [AB3] = 0,60
Qual o valor da constante de equilíbrio da reação acima?
- 1,5
- 15
- 150
- 225
- 300
05. (UFRN) O equilíbrio químico se caracteriza por ser uma dinâmica em nível microscópico. Para se ter uma informação quantitativa da extensão do equilíbrio químico, usa-se a grandeza constante de equilíbrio. Considere a tirinha a seguir:

Aplicada ao equilíbrio químico, a ideia que o personagem tem sobre equilíbrio:
- É correta, pois, no equilíbrio químico, metade das quantidades sempre é de produtos, e a outra metade é de reagentes.
- Não é correta, pois, no equilíbrio químico, as concentrações de produtos e as de reagentes podem ser diferentes, mas são constantes.
- É correta, pois, no equilíbrio químico, as concentrações de reagentes e as de produtos sempre são iguais, desde que o equilíbrio não seja perturbado por um efeito externo.
- Não é correta, pois, no equilíbrio químico, as concentrações dos produtos sempre são maiores que as dos reagentes, desde que o equilíbrio não seja afetado por um fator externo.
- É correta, pois, no equilíbrio químico, as concentrações de reagentes e as de produtos sempre não são iguais.
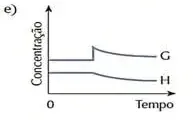
06. (UFPE) No início do século XX, a expectativa da Primeira Guerra Mundial gerou uma grande necessidade de compostos nitrogenados. Haber foi o pioneiro na produção de amônia, a partir do nitrogênio do ar. Se a amônia for colocada num recipiente fechado, sua decomposição ocorre de acordo com a seguinte equação química não balanceada: NH3(g) → N2(g) + H2(g). As variações das concentrações com o tempo estão ilustradas na figura a seguir:
A partir da análise da figura acima, podemos afirmar que as curvas A, B e C representam a variação temporal das concentrações dos seguintes componentes da reação, respectivamente:
- H2, N2 e NH3
- NH3, H2 e N2
- NH3, N2 e H2
- N2, H2 e NH3
- H2, NH3 e N2
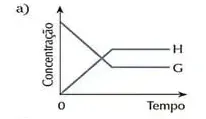
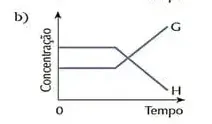
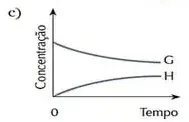
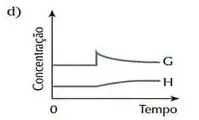
07. (Cesgranrio) O sistema representado pela equação F + G ⇄ H estava em equilíbrio. O estado de equilíbrio foi alterado bruscamente por uma adição da substância G. O sistema reage no sentido de restabelecer o equilíbrio. Qual dos gráficos a seguir melhor representa as modificações ocorridas ao longo do processo descrito?
08. (ITA–SP) Um mol de hidrogênio é misturado com um mol de iodo num recipiente de um litro a 500°C, onde se estabelece o equilíbrio H2(g) + I2(g) D 2 HI(g). Se o valor da constante de equilíbrio (Kc) for 49, a concentração de HI no equilíbrio em mol/litro valerá:
- 1/9
- 14/9
- 2/9
- 7/9
- 11/9
09. (PUC-RIO) Reações químicas dependem de energia e colisões eficazes que ocorrem entre as moléculas dos reagentes. Em sistema fechado, é de se esperar que o mesmo ocorra entre as moléculas dos produtos em menor ou maior grau até que se atinja o chamado “equilíbrio químico”.
O valor da constante de equilíbrio em função das concentrações das espécies no equilíbrio, em quantidade de matéria, é um dado importante para se avaliar a extensão (rendimento) da reação quando as concentrações não se alteram mais.
Considere a tabela com as quantidades de reagentes e produtos no início e no equilíbrio, na temperatura de 100oC, para a seguinte reação:
A constante de equilíbrio tem o seguinte valor:
- 0,13
- 0,27
- 0,50
- 1,8
- 3,0
10. (UNESP) Considere a reação química que está ocorrendo nas hemácias de uma pessoa.
Considere que esse equilíbrio esteja deslocando-se preferencialmente para a direita. Pode-se inferir que:
- o pH sanguíneo está aumentando, indicando que essa pessoa está realizando esforço físico intenso
- a maior parte de gás carbônico presente no sangue é proveniente da quebra da glicose que ocorre no citosol das hemácias.
- essa pessoa encontra-se num ambiente com baixa concentração de oxigênio e passa a realizar fermentação láctica que produz gás carbônico baixando o pH sanguíneo.
- o aumento da acidez sanguínea é prontamente detectado pelo bulbo que aumenta a estimulação dos músculos envolvidos na respiração, aumentando a frequência respiratória.
- o aumento do teor de gás carbônico no sangue é detectado por receptores químicos localizados nas paredes da veias cavas e artérias pulmonares, que enviam mensagem ao bulbo provocando aumento da frequência respiratória.