Mistura de soluções: Sem Ocorrência de Reação Química
Lista de 10 exercícios de Química com gabarito sobre o tema Mistura de soluções: Sem Ocorrência de Reação Química com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Mistura de soluções: Sem Ocorrência de Reação Química.
01. (PUC-RS) Uma solução foi preparada misturando-se 200 ml de uma solução de HBr 0,20 mol/L com 300 ml de solução de HCℓ 0, 1O mol/L. As concentrações, em mol/L, dos íons Br-, cℓ- e H+ na solução serão, respectivamente
- 0,04; 0,03; 0,04
- 0,04; 0,03; 0,07
- 0,08; 0,06; 0,06
- 0,08; 0,06; O,14
- 0,2; 0, 1; 0,3
02. (UNEB) O "soro caseiro" consiste em uma solução aquosa de cloreto de sódio (3,5 g/L) e de sacarose (11 g/L); respectivamente, a massa de cloreto de sódio e a de sacarose necessárias para preparar 500 ml de soro caseiro são:
- 17,5 g e 55 g.
- 175 g e 550 g.
- 1750 mg e 5500 mg.
- 17,5 mg e 55 mg.
- 175 mg e 550 mg.
03. (UFES) Misturando-se 60,0 ml de solução de HCℓ de concentração 2,0 mol/L com 40,0 ml de solução de HCℓ de concentração 4,5 mol/L, obtém-se uma solução de HCℓ, de concentração, em gramas por litro (g/L), igual a:
(Dados: H = 1; Cℓ = 35,5.)
- 3,0
- 10,5
- 36,5
- 109,5
- 365,0
04. (UFRGS) Misturam-se volumes iguais de duas soluções A e 8 de NaOH, de concentração 1 mol/L e 2 mol/L, respectivamente, resultando uma solução C. Adicionando-se 200 ml de água à solução C, obtém-se a solução D. Sobre essas soluções pode-se afirmar que:
- C e D apresentam diferentes quantidades de soluto.
- 8 e D têm concentrações iguais.
- a concentração de C é 1,5 mol/L e a de D é maior que 1,5 mol/L.
- a concentração de C é 1,5 mol/litro e a de D é menor que 1,5 mol/litro.
- A e 8 apresentam a mesma quantidade de soluto.
05. (Uece) Um recipiente contém 150 ml de solução de cloreto de potássio 4,0 mol/L, e outro recipiente contém 350 ml de solução de sulfato de potássio 3,0 mol/L. Depois de misturarmos as soluções dos dois recipientes, as concentrações em quantidade de matéria em relação aos íons K+ e SO42- serão, respectivamente:
- 4,2 mol/L e 2, 1 mol/L.
- 4,2 mol/L e 3,6 mol/L.
- 5,4 mol/L e 2, 1 mol/L.
- 5,4 mol/L e 3,6 mol/L.
06. (UFRGS) Misturando-se 250 ml de solução 0,600 mol/L de KCℓ com 750 ml de solução 0,200 mol/L de BaCℓ2, obtém-se uma solução cuja concentração de íon cloreto, em mol/L, é igual a
- 0,300
- 0,400
- 0,450
- 0,600
- 0,800
07. (Cefet-MG) A figura ao lado ilustra um recipiente onde foram misturados volumes iguais de duas soluções, cujas densidades valem 1,100 g · ml -1 e 1,020 g · ml -1. Ao mergulharmos uma esfera de massa 300 mg e volume 0,5 cm³ no recipiente ao lado, ela se posicionará no ponto:
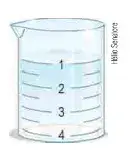
- 1
- 2
- 3
- 4
08. (UPE) O volume de água destilada que deve ser adicionado a uma mistura contendo 100,0 ml de hidróxido de sódio 0,5 mol/L, com 25,0 g de solução do mesmo hidróxido a 40% em massa e densidade 1,25 g/ml, de modo a se obter uma solução 0,25 mol/L, é:
Dado: massa molar do hidróxido = 40 g/mol.
- 1 200,0 ml
- 108,0 ml
- 1 080,0 L
- 1,08 L
- 1,2 ml
09. (UA-AM) Uma solução de 2,0 litros de NaOH, com concentração 40 g/L, é misturada com 3 litros de solução de KOH de concentração 60 g/L. Suas concentrações finais de mol/L, após a mistura, são, respectivamente: (Dados: Na= 23 g/mol, O= 16 g/mol, H = 1 g/mol, K = 39 g/mol.)
- 1,0 e 1,32.
- 0,4 e 0,66.
- 0,4 e 0,4.
- 0,55 e 0,66.
- 0,4 e 1,32.
10. (UFMG)
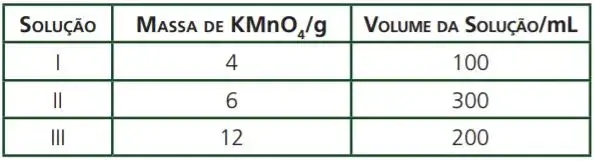
Analise o quadro quanto às concentrações das soluções e assinale a alternativa correta.
- Se adicionarmos a solução II à solução III, a concentração final será menor que a da solução I.
- Se adicionarmos 100 ml de água à solução I, a concentração final será a mesma da solução III.
- A solução mais concentrada é a que tem o menor volume.
- A solução mais diluída é a que tem a maior massa de soluto