Os coeficientes e as Quantidades de Substância (mol)
Lista de 10 exercícios de Química com gabarito sobre o tema Os coeficientes e as Quantidades de Substância (mol) com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema aqui.
01. (UFSM) Em nossos dias, as reações de combustão de matéria orgânica ainda são a principal fonte de energia para transportes automotivos ou para nossas cozinhas. O produto principal da queima dos hidrocarbonetos é o dióxido de carbono. Quantos mols de dióxido de carbono serão produzidos na combustão completa de 1,5 mol de butano?
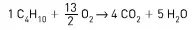
- 3,0
- 4,0
- 5,0
- 6,0
- 7,0
02. (UFRGS-RS) A combustão completa da glicose, C6H12O6, é responsável pelo fornecimento de energia ao organismo humano. Na combustão de 1,0 mol de glicose, o número de gramas de água formado é igual a
(Dados: H = 1; O= 16; C = 12.)
C6H12O6 + 6 02 ⟶ 6 CO2 + 6 H2O
- 6
- 12
- 18
- 108
- 180
03. (UFF) “Na natureza nada se cria, nada se perde, tudo se transforma” é a definição do químico francês Antoine Lavoisier (1743-1794) para sua teoria de conservação da matéria. Ele descobriu que a combustão de uma matéria só acontece com o oxigênio, contrariando a teoria do alemão Stahl. O hábito de sempre pesar na balança tudo o que analisava levou Lavoisier a descobrir que a soma das massas dos reagentes é igual à soma das massas dos produtos de uma reação e, assim, a criar a Lei de Conservação das Massas. Considere a reação não balanceada a seguir:
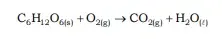
Com base nos ensinamentos de Lavoisier, pode-se afirmar que para reagir com 25,0 g de glicose
Dados: C = 12; H = 1; O = 16
- são necessárias 15,0 g de CO2.
- são produzidas 36,7 g de H2O.
- são necessárias 32,0 g de O2.
- são produzidas 44,0 g de CO2.
- são necessárias 26,7 g de O2.
04. (UESPI) Na atmosfera artificial dos submarinos e espaçonaves, o gás carbônico gerado pela tripulação deve ser removido do ar, e o oxigênio precisa ser recuperado. Com isso em mente, grupos de projetistas de submarinos investigaram o uso do superóxido de potássio, KO2, como purificador de ar, uma vez que essa substância reage com CO2 e libera oxigênio, como mostra a equação química abaixo:
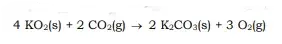
Considerando esta reação, determine a massa de superóxido de potássio necessária para reagir com 100,0 L de CO2 a 27 ºC e a1 atm.
Dados: Massas molares em g.mol-1: C = 12; O = 16; K = 39; R = 0,082 atm.L.mol-1 .K-1
- 5,8 • 10²
- 2,9 • 10²
- 1,7 • 10²
- 6,3 • 10
- 4,0 • 10
05. (UFV-MG) Os pisos de mármore muitas vezes são lavados de forma inadequada pelo uso de ácido muriático (nome comercial de uma solução aquosa impura de ácido clorídrico). A reação de carbonato de cálcio, principal constituinte do mármore, com ácido clorídrico leva ao seu desgaste, devido à reação representada abaixo:
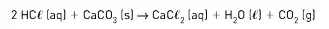
A massa (em g) de CaC03 de um piso de mármore consumida pela reação de 4 L de HCℓ 0,1 mol · L-1 é:
- O,1
- 20
- 1O
- 2
06. (Fuvest) Nas estações de tratamento de água, eliminam-se as impurezas sólidas em suspensão através do arraste por flóculos de hidróxido de alumínio, produzidos na reação representada por
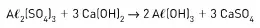
Para tratar 1,0 · 106 m³ de água, foram adicionadas 17 toneladas de Aℓ2(SO4)3.
Qual é a massa de Ca(OH)2 necessária para reagir completamente com esse sal?
(Dados: massas molares: Aℓ2(SO4)3 = 342 g/mol; Ca(OH)2 = 74 g/mol.)
- 150 kg
- 300 kg
- 1,0 toneladas
- 11 toneladas
- 30 toneladas
07. (UFPE) Nas usinas siderúrgicas, a obtenção de ferro metálico a partir da hematita envolve a seguinte reação (não balanceada):
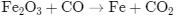
Percebe-se desta reação que o CO2 é liberado para atmosfera, podendo ter um impacto ambiental grave relacionado com o efeito estufa. Qual o número de moléculas de CO2 liberadas na atmosfera, quando um mol de óxido de ferro (III) é consumido na reação? Considere: número de Avogadro igual a 6 x 1023 mol-1:
- 6 x 1023
- 24 x 1023
- 12 x 1023
- 36 x 1023
- 18 x 1023
08. (UfSCar) O funcionamento de “air-bag” de veículos automotores é baseado na reação química representada pela equação:
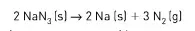
A reação é iniciada por um sensor de choque, e ocorre rapidamente, com o N2 formado preenchendo o “air-bag” em cerca de 0,03 s. O Na(s) formado na reação, por ser muito reativo é consumido por reação rápida com outro reagente presente na mistura inicial de reagentes, Se no funcionamento de um “air-bag” 130 g de NaN3 forem totalmente decompostos, pode-se afirmar que:
- serão produzidos 23 g de Na (s)
- serão produzidos 21 g de N2 (g)
- serão produzidos 84 g de N2 (g)
- o gás produzido ocupará um volume de 22,4 litros nas condições normais de pressão e temperatura (CNTP)
- se o Na(s) formado reagisse com água, a água seria decomposta, liberando oxigênio gasoso e grande quantidade de calor.
09. (UFTM) Hidrogênio gasoso (H2) pode ser obtido em laboratório pela reação de magnésio com ácido clorídrico. Admitindo comportamento ideal, calcula-se que o volume, em litros, de hidrogênio a 27ºC e 623 mmHg, obtido pela reação completa de 1,2 g de magnésio é, aproximadamente:
(Dados: R = 62,3 mmHg • L • mol-1 • K-1; massa molar do magnésio= 24 g • mol-1.)
- 0,5
- 1,0
- 1,5
- 2,0
- 2,5
10. (UEL-PR) O dióxido de carbono, gerado pelos tripulantes em uma atmosfera artificial de um submarino ou de uma cápsula espacial, deve ser removido e o gás oxigênio recuperado. O superóxido de potássio é um composto interessante para ser utilizado com este propósito porque reage com o dióxido de carbono liberando o oxigênio, de acordo com a reação.
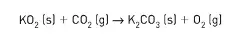
Considerando a reação (equação não balanceada) e os compostos que dela participam, é correto afirmar:
- Esta reação ocorre com facilidade porque é uma reação entre um óxido ácido (KO2) e um óxido básico (CO2).
- Os coeficientes estequiométricos, na ordem em que as substâncias aparecem na equação, após correto balanceamento, são 2, 3, 2, 4.
- Se forem exalados 160,0 litros de C02 sob condições de 760,0 mmHg e 25ºC, a massa de K02 necessária para consumir todo o C02 é de 1 360 g.
- Para uma massa de 4350 g de K02, o volume de 02 produzido, sob condições de 1,500 atm e 28 ºC, é de aproximadamente 755,3 litros.
- Para qualquer massa de K02 utilizada, os volumes de C02 consumido e de 02 liberado, nas mesmas condições de pressão e temperatura, serão iguais.