Cálculo Estequiométrico
Lista de 29 exercícios de Química com gabarito sobre o tema Cálculo Estequiométrico com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Cálculo Estequiométrico.
01. (Enem 2025) A química nuclear é uma importante ferramenta na produção de substâncias utilizadas na área da saúde humana. A radiação emitida pelo cobalto-60 é utilizada na medicina como ferramenta de diagnóstico e no tratamento do câncer. No entanto, esse radioisótopo tem um tempo de armazenamento limitado, pois seu tempo de meia-vida é de 5,3 anos. Considere um frasco com uma amostra contendo 2,00 mg de cobalto-60, armazenado durante um período de 26,5 anos.
A massa de cobalto-60, em miligrama, que restará ao final desse tempo é mais próxima de
- 2,00 mg.
- 1,00 mg.
- 0,40 mg.
- 0,13 mg.
- 0,06 mg.
02. (Enem 2025) O Brasil é o maior produtor mundial de nióbio (massa molar = 93 g mol–1), metal utilizado na fabricação de vários tipos de aço: automotivos, estruturais e inoxidáveis. O processo utilizado na produção do nióbio é a redução aluminotérmica de Nb2O5 com excesso de 10% de Al (massa molar = 27 g mol–1), em relação à quantidade estequiométrica da reação, representada pela equação química:
3 Nb2O5(s) + 10 Al(s) → 6 Nb(s) + 5 Al2O3(s)
Uma engenheira metalúrgica estimou a massa de alumínio necessária para produzir 9,3 kg de nióbio, nas condições descritas, para a produção de um lote de peças de aço encomendado por uma indústria, considerando um rendimento de 100%.
Disponível em: www.cbmm.com.br. Acesso em: 17 out. 2015 (adaptado).
A massa de alumínio, em quilograma, estimada pela engenheira é mais próxima de
- 2,7 kg.
- 3,0 kg.
- 4,1 kg.
- 4,5 kg.
- 5,0 kg.
03. (Enem 2025) Apaixonada por culinária e química, uma chefe de cozinha calculou que, para promover o crescimento adequado da massa durante o cozimento de um bolo a 180 ºC (453 K) e 1,00 atm, ela precisaria utilizar uma quantidade de fermento químico suficiente para produzir um volume de gás igual a 4,00 L. Com esse objetivo, ela escolheu utilizar o bicarbonato de amônio, um composto que, sob aquecimento, degrada-se em três gases distintos, que são os responsáveis pelo crescimento da massa. A decomposição do bicarbonato de amônio ocorre conforme a equação química apresentada e, nas condições do cozimento, seu rendimento é de 80%.
NH4HCO3 (s) → NH3 (g) + CO2 (g) + H2O (g)
Considere que a mistura dos gases se comporta como gás ideal nas condições de cozimento utilizadas pela chefe.
Dados: Massa molar do NH4HCO3 = 79 g . mol–1 e R = 0,082 atm . L . mol–1. K–1.
A massa, em grama, de bicarbonato de amônio que ela deve utilizar é mais próxima de
- 2,3 g.
- 3,5 g.
- 5,9 g.
- 6,8 g.
- 8,9 g.
04. (Enem 2022) O etanol é um combustível produzido a partir da fermentação da sacarose presente no caldo de cana-de-açúcar. Um dos fatores que afeta a produção desse álcool é o grau de deterioração da sacarose, que se inicia após o corte, por causa da ação de microrganismos. Foram analisadas cinco amostras de diferentes tipos de cana-de-açúcar e cada uma recebeu um código de identificação. No quadro são apresentados os dados de concentração de sacarose e de microrganismos presentes nessas amostras.

Pretende-se escolher o tipo de cana-de-açúcar que conterá o maior teor de sacarose 10 horas após o corte e que, consequentemente, produzirá a maior quantidade de etanol por fermentação. Considere que existe uma redução de aproximadamente 50% da concentração de sacarose nesse tempo, para cada 1,0 mg L-1 de microrganismos presentes na cana-de-açúcar.
Disponível em: www.Inovacao.unicamp.br. Acesso em: 11 ago. 2012 (adaptado).
Qual tipo de cana-de-açúcar deve ser escolhido?
- RB72
- RB84
- RB92
- SP79
- SP80
05. (Enem PPL 2° Dia 2018) Pesquisadores desenvolveram uma nova e mais eficiente rota sintética para produzir a substância atorvastatina, empregada para reduzir os níveis de colesterol. Segundo os autores, com base nessa descoberta, a síntese da atorvastatina cálcica (CaC₆₆H₆₈F₂N₄O₁₀, massa molar igual a 1154 g/mol) é realizada a partir do éster 4-metil-3-oxopentanoato de metila (C₇H₁₂O₃, massa molar igual a 144 g/mol).
Unicamp descobre nova rota para produzir medicamento mais vendido no mundo. Disponível em: www.unicamp.br. Acesso em: 26 out. 2015 (adaptado).
Considere o rendimento global de 20% na síntese da atorvastatina cálcica a partir desse éster, na proporção de 1 : 1. Simplificadamente, o processo é ilustrado na figura.
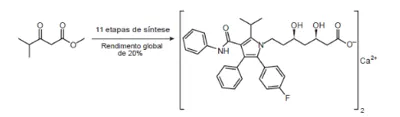
Considerando o processo descrito, a massa, em grama, de atorvastatina cálcica obtida a partir de 100 g do éster é mais próxima de
- 20.
- 29.
- 160.
- 202.
- 231.
06. (Enem 1ª Aplicação - 1° Dia 2016) Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P.; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado)
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
- 1.
- 29.
- 60.
- 170.
- 1 000.
07. (Enem PPL 2020) Os esgotos domésticos são, em geral, fontes do íon tripolifosfato (P3O105−, de massa molar igual a 253 g mol−1), um possível constituinte dos detergentes. Esse íon reage com a água, como mostra a equação a seguir, e produz o íon fosfato (PO43−, de massa molar igual a 95 g mol−1), um contaminante que pode causar a morte de um corpo hídrico. Em um lago de 8 000 m3, todo o fósforo presente é proveniente da liberação de esgoto que contém 0,085 mg L−1 de íon tripolifosfato, numa taxa de 16 m3 por dia. De acordo com a legislação brasileira, a concentração máxima de fosfato permitido para água de consumo humano é de 0,030 mg L−1.
P3O105− (aq) + 2 H2O (l) → 3 PO43− (aq) + 4 H+ (aq)
O número de dias necessário para que o lago alcance a concentração máxima de fósforo (na forma de íon fosfato) permitida para o consumo humano está mais próximo de
- 158.
- 177.
- 444.
- 1 258.
- 1 596.
08. (Enem PPL 1° Dia 2015) O álcool utilizado como combustível automotivo (etanol hidratado) deve apresentar uma taxa máxima de água em sua composição para não prejudicar o funcionamento do motor. Uma maneira simples e rápida de estimar a quantidade de etanol em misturas com água é medir a densidade da mistura. O gráfico mostra a variação da densidade da mistura (água e etanol) com a fração percentual da massa de etanol (fe), dada pela expressão fe = me/(me + ma), em que me e ma são as massas de etanol e de água na mistura, respectivamente, a uma temperatura de 20 °C.

Suponha que, em uma inspeção de rotina realizada em determinado posto, tenha-se verificado que 50,0 cm3 de álcool combustível tenham massa igual a 45,0 g.
Qual é a fração percentual de etanol nessa mistura?

- 7%
- 10%
- 55%
- 90%
- 93%
09. (Enem PPL 1° Dia 2014) O álcool comercial (solução de etanol) é vendido na concentração de 96%, em volume. Entretanto, para que possa ser utilizado como desinfetante, deve-se usar uma solução alcoólica na concentração de 70%, em volume. Suponha que um hospital recebeu como doação um lote de 1 000 litros de álcool comercial a 96%, em volume, e pretende trocá-lo por um lote de álcool desinfetante.
Para que a quantidade total de etanol seja a mesma nos dois lotes, o volume de álcool a 70% fornecido na troca deve ser mais próximo de
- 1 042 L.
- 1 371 L.
- 1 428 L.
- 1 632 L.
- 1 700 L.
10. (Enem 2012) Aspartame é um edulcorante artificial (adoçante dietético) que apresenta potencial adoçante 200 vezes maior que o açúcar comum, permitindo seu uso em pequenas quantidades. Muito usado pela indústria alimentícia, principalmente nos refrigerantes diet, tem valor energético que corresponde a 4 calorias/grama. É contraindicado a portadores de fenilcetonúria, uma doença genética rara que provoca o acúmulo da fenilalanina no organismo, causando retardo mental. O IDA (índice diário aceitável) desse adoçante é 40 mg/kg de massa corpórea.
Disponível em: http://boaspraticasfarmaceuticas.blogspot.com. Acesso em: 27 fev. 2012.
Com base nas informações do texto, a quantidade máxima recomendada de aspartame, em mol, que uma pessoa de 70 kg de massa corporal pode ingerir por dia é mais próxima de
Dado: massa molar do aspartame = 294 g/mol
- 1,3 × 10–4.
- 9,5 × 10–3.
- 4 × 10–2.
- 2,6.
- 823.
11. (Enem PPL 2023) Um carro sedã apresenta tipicamente 200 kg de alumínio distribuídos pelo chassi, motor e cabine. Uma amostra de bauxita, principal fonte natural do metal, é composta por 50% em massa de óxido de alumínio (Al2O3). Considere a massa molar do alumínio (Al) igual a 27 g mol−1 e a do oxigênio (O) igual a 16 g mol−1.
A massa de bauxita que deve ser empregada para produzir o alumínio usado na fabricação de um carro desse modelo é mais próxima de
- 378 kg.
- 400 kg.
- 637 kg.
- 756 kg.
- 1 512 kg.
12. (Enem 2006) Para se obter 1,5 kg do dióxido de urânio puro, matéria-prima para a produção de combustível nuclear, é necessário extrair-se e tratar-se 1,0 tonelada de minério. Assim, o rendimento (dado em % em massa) do tratamento do minério até chegar ao dióxido de urânio puro é de
- 0,10%.
- 0,15%.
- 0,20%.
- 1,5%.
- 2,0%.
13. (Enem PPL 2018) Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha. A reação não balanceada que ocorre é:
Ag2S (s) + Al(s) → Al2S3 (s) + Ag (s)
Dados da massa molar dos elementos (g mol-1): Ag = 108; S = 32.
UCKO, D. A. Química para as ciências da saúde: uma introdução à química geral, orgânica e biológica. São Paulo: Manole, 1995 (adaptado).
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
- 0,54 g.
- 1,08 g.
- 1,91 g.
- 2,16 g.
- 3,82 g.
14. (Enem PPL 2018) As indústrias de cerâmica utilizam argila para produzir artefatos como tijolos e telhas. Uma amostra de argila contém 45% em massa de sílica (SiO2) e 10% em massa de água (H2O). Durante a secagem por aquecimento em uma estufa, somente a umidade é removida.
Após o processo de secagem, o teor de sílica na argila seca será de
- 45%.
- 50%.
- 55%.
- 90%.
- 100%.
15. (Enem PPL 2° Dia 2018) As soluções de hipoclorito de sódio têm ampla aplicação como desinfetantes e alvejantes. Em uma empresa de limpeza, o responsável pela área de compras deve decidir entre dois fornecedores que têm produtos similares, mas com diferentes teores de cloro.
Um dos fornecedores vende baldes de 10 kg de produto granulado, contendo 65% de cloro ativo, a um custo de R$ 65,00. Outro fornecedor oferece, a um custo de R$ 20,00, bombonas de 50 kg de produto líquido contendo 10% de cloro ativo.
Considerando apenas o quesito preço por kg de cloro ativo e desprezando outras variáveis, para cada bombona de 50 kg haverá uma economia de
- R$ 4,00.
- R$ 6,00.
- R$ 10,00.
- R$ 30,00.
- R$ 45,00.
16. (Enem LIBRAS 2017) A ingestão de vitamina C (ou ácido ascórbico; massa molar igual a 176 g/mol) é recomendada para evitar o escorbuto, além de contribuir para a saúde de dentes e gengivas e auxiliar na absorção de ferro pelo organismo. Uma das formas de ingerir ácido ascórbico é por meio dos comprimidos efervescentes, os quais contêm cerca de 0,006 mol de ácido ascórbico por comprimido. Outra possibilidade é o suco de laranja, que contém cerca de 0,07 g de ácido ascórbico para cada 200 mL de suco.
O número de litros de suco de laranja que corresponde à quantidade de ácido ascórbico presente em um comprimido efervescente é mais próximo de
- 0,002.
- 0,03.
- 0,3.
- 1.
- 3.
17. (Enem PPL 2° Dia 2017) No Brasil, os postos de combustíveis comercializavam uma gasolina com cerca de 22% de álcool anidro. Na queima de 1 litro desse combustível são liberados cerca de 2 kg de CO2 na atmosfera. O plantio de árvores pode atenuar os efeitos dessa emissão de CO2. A quantidade de carbono fixada por uma árvore corresponde a aproximadamente 50% de sua biomassa seca, e para cada 12 g de carbono fixados, 44 g de CO2 são retirados da atmosfera. No brasil, o plantio de eucalípto (Eucalyptus grandis) é bem difundido, sendo que após 11 anos essa árvore pode ter a massa de 106 kg, dos quais 29 kg são água.
Uma única árvore de Eucalyptus grandis, com as características descritas, é capaz de fixar a quantidade de CO2 liberada na queima de um volume dessa gasolina mais próxima de
- 19 L.
- 39 L.
- 71 L.
- 97 L.
- 141 L.
18. (Enem PPL 2017) Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.

Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite mais CO2 é o
- etano.
- butano.
- metano.
- propano.
- acetileno.
19. (Enem 2017) A toxicidade de algumas substâncias é normalmente representada por um índice conhecido como DL50 (dose letal mediana). Ele representa a dosagem aplicada a uma população de seres vivos que mata 50% desses indivíduos e é normalmente medido utilizando-se ratos como cobaias. Esse índice é muito importante para os seres humanos, pois ao se extrapolar os dados obtidos com o uso de cobaias, pode-se determinar o nível tolerável de contaminação de alimentos, para que possam ser consumidos de forma segura pelas pessoas. O quadro apresenta três pesticidas e suas toxicidades. A unidade mg/kg indica a massa da substância ingerida pela massa da cobaia.

Sessenta ratos, com massa de 200 g cada, foram divididos em três grupos de vinte. Três amostras de ração, contaminadas, cada uma delas com um dos pesticidas indicados no quadro, na concentração de 3 mg por grama de ração, foram administradas para cada grupo de cobaias. Cada rato consumiu 100 g de ração.
Qual(ais) grupo(s) terá(ão) uma mortalidade mínima de 10 ratos?
- O grupo que se contaminou somente com atrazina.
- O grupo que se contaminou somente com diazinon.
- Os grupos que se contaminaram com atrazina e malation.
- Os grupos que se contaminaram com diazinon e malation.
- Nenhum dos grupos contaminados com atrazina, diazinon e malation.
20. (Enem 3ª 2016) As emissões de dióxido de carbono (CO2) por veículos são dependentes da constituição de cada tipo de combustível. Sabe-se que é possível determinar a quantidade emitida de CO2, a partir das massas molares do carbono e do oxigênio, iguais a 12 g/mol e 16 g/mol, respectivamente. Em uma viagem de férias, um indivíduo percorreu 600 km em um veículo que consome um litro de gasolina a cada 15 km de percurso.
Considerando que o conteúdo de carbono em um litro dessa gasolina é igual a 0,6 kg, a massa de CO2 emitida pelo veículo no ambiente, durante a viagem de férias descrita, é igual a
- 24 kg.
- 33 kg.
- 40 kg.
- 88 kg.
- 147 kg.
21. (Enem 3ª Aplicação) A obtenção de energia por meio da fissão nuclear do 235U é muito superior quando comparada à combustão da gasolina. O calor liberado na fissão do 235U é 8 × 1010 J/g e na combustão da gasolina é 5 × 104 J/g.
A massa de gasolina necessária para obter a mesma energia na fissão de 1 kg de 235U é da ordem
- 103 g.
- 104 g.
- 105 g.
- 106 g.
- 109 g.
22. (Enem PPL 1° Dia 2016) As emissões de dióxido de carbono (CO2) por veículos são dependentes da constituição de cada tipo de combustível. Sabe-se que é possível determinar a quantidade emitida de CO2, a partir das massas molares do carbono e do oxigênio, iguais a 12 g/mol e 16 g/mol, respectivamente. Em uma viagem de férias, um indivíduo percorreu 600 km em um veículo que consome um litro de gasolina a cada 15 km de percurso.
Considerando que o conteúdo de carbono em um litro dessa gasolina é igual a 0,6 kg, a massa de CO2 emitida pelo veículo no ambiente, durante a viagem de férias descrita, é igual a
- 24 kg.
- 33 kg.
- 40 kg.
- 88 kg.
- 147 kg.
23. (Enem 2015) A hidroponia pode ser definida como uma técnica de produção de vegetais sem necessariamente a presença de solo. Uma das formas de implementação é manter as plantas com suas raízes suspensas em meio líquido, de onde retiram os nutrientes essenciais. Suponha que um produtor de rúcula hidropônica precise ajustar a concentração do íon nitrato (NO3-) para 0,009 mol/L em um tanque de 5 000 litros e, para tanto, tem em mãos uma solução comercial nutritiva de nitrato de cálcio 90 g/L. As massas molares dos elementos N, O e Ca são iguais a 14 g/mol, 16 g/mol e 40 g/mol, respectivamente.
Qual o valor mais próximo do volume da solução nutritiva, em litros, que o produtor deve adicionar ao tanque?
- 26
- 41
- 45
- 51
- 82
24. (Enem PPL 2014) Em um caso de anemia, a quantidade de sulfato de ferro(II) (FeSO4, massa molar igual a 152 g/mol) recomendada como suplemento de ferro foi de 300 mg/dia. Acima desse valor, a mucosa intestinal atua como barreira, impedindo a absorção de ferro. Foram analisados cinco frascos de suplemento, contendo solução aquosa de FeSO4, cujos resultados encontram-se no quadro.

Se for ingerida uma colher (10 mL) por dia do medicamento para anemia, a amostra que conterá a concentração de sulfato de ferro(II) mais próxima da recomendação é a do frasco de número
- 1.
- 2.
- 3.
- 4.
- 5.
25. (Enem PPL 2014) A água potável precisa ser límpida, ou seja, não deve conter partículas em suspensão, tais como terra ou restos de plantas, comuns nas águas de rios e lagoas. A remoção das partículas é feita em estações de tratamento, onde o Ca(OH)2 em excesso e Al2(SO4)3 são adicionados em um tanque para formar sulfato de cálcio e hidróxido de alumínio. Esse último se forma como flocos gelatinosos insolúveis em água, que são capazes de agregar partículas em suspensão. Em uma estação de tratamento, cada 10 gramas de hidróxido de alumínio é capaz de carregar 2 gramas de partículas. Após a decantação e filtração, a água límpida é tratada com cloro e distribuída para as residências. As massas molares dos elementos H, O, Al, S e Ca são, respectivamente, 1 g/mol, 16 g/mol, 27 g/mol, 32 g/mol e 40 g/mol.
Considerando que 1 000 litros da água de um rio possuem 45 gramas de partículas em suspensão, a quantidade mínima de Al2(SO4)3 que deve ser utilizada na estação de tratamento de água, capaz de tratar 3000 litros de água de uma só vez, para garantir que todas as partículas em suspensão sejam precipitadas, é mais próxima de
- 59 g.
- 493 g.
- 987 g.
- 1 480 g.
- 2 960 g.
26. (Enem 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém cerca de 3,3% de carbono. Uma forma de eliminar o excesso de carbono é a oxidação a partir do aquecimento do ferro-gusa com gás oxigênio puro. Os dois principais produtos formados são aço doce (liga de ferro com teor de 0,3% de carbono restante) e gás carbônico. As massas molares aproximadas dos elementos carbono e oxigênio são, respectivamente, 12 g/mol e 16 g/mol.
LEE, J. D. Química Inorgânica não tão concisa. São Paulo: Edgard Blucher, 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
- 28.
- 75.
- 175.
- 275.
- 303.
27. (Enem PPL 2012) Pesquisadores conseguiram produzir grafita magnética por um processo inédito em forno com atmosfera controlada e em temperaturas elevadas. No forno são colocados grafita comercial em pó e óxido metálico, tal como CuO. Nessas condições, o óxido é reduzido e ocorre a oxidação da grafita, com a introdução de pequenos defeitos, dando origem à propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de 100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: Massa molar em g/mol: C = 12; O = 16; Cu = 64
- 2,2 g.
- 2,8 g.
- 3,7 g.
- 4,4 g.
- 5,5 g.
28. (Enem PPL 1° Dia 2011) Três amostras de minérios de ferro de regiões distintas foram analisadas e os resultados, com valores aproximados, estão na tabela:

Os minérios que apresentam, respectivamente, a maior pureza e o menor consumo de carvão por tonelada de ferro produzido são os das regiões:
- A com 75% e C com 143 kg.
- B com 80% e A com 161 kg.
- C com 85% e B com 107 kg.
- A com 90% e B com 200 kg.
- B com 95% e A com 161 kg.
29. (Enem PPL 2022) Os airbags de segurança dos automóveis são acionados com o impacto, que envia um sinal elétrico para o dispositivo e inicia a reação explosiva do trinitreto de sódio (NaN3), produzindo sódio metálico e nitrogênio molecular, conforme a equação:
2 NaN3 (s) → 2 Na (s) + 3 N2 (g)
O gás produzido tem função de inflar o airbag. Esse tipo de dispositivo contém, aproximadamente, 100 g de NaN3.
Considere: PV = nRT; P = 1 atm; T = 25 °C;
R = 0,0821 L · atm/K · mol; 0 °C = 273 K
Massas molares: NaN3 = 65 g/mol; N2 = 28 g/mol; Na 23 g/mol
Nesse dispositivo, o volume de gás produzido, em litro, é
- 4,7.
- 9,4.
- 18,8.
- 56,5.
- 113,0.