Equacionamento e Balanceamento de Equações
Lista de 5 exercícios de Química com gabarito sobre o tema Equacionamento e Balanceamento de Equações com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Equacionamento e Balanceamento de Equações.
01. (Enem Digital 2020) O reagente conhecido como Kastle-Meyer é muito utilizado por investigadores criminais para detectar a presença de sangue. Trata-se de uma solução aquosa incolor, preparada com zinco metálico, hidróxido de sódio (Reação 1) e indicador (Reação 2). Essa solução, quando em contato com a hemoglobina contida no sangue e na presença de água oxigenada (Reação 3), passa de incolor para vermelha, indicando a presença de sangue no local, conforme as reações descritas.
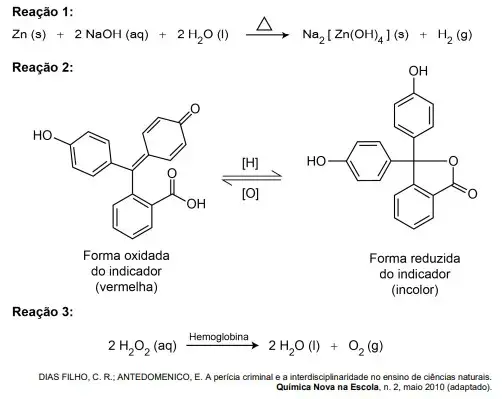
A mudança de coloração que indica a presença de sangue ocorre por causa da reação do indicador com o(a)
- sal de Na2[Zn(OH)4] na presença de hemoglobina.
- água produzida pela decomposição da água oxigenada.
- hemoglobina presente na reação com a água oxigenada.
- gás oxigênio produzido pela decomposição da água oxigenada.
- gás hidrogênio produzido na reação do zinco com hidróxido de sódio.
02. (Enem PPL 1° Dia 2014) Os bafômetros (etilômetros) indicam a quantidade de álcool, C2H6O (etanol), presente no organismo de uma pessoa através do ar expirado por ela. Esses dispositivos utilizam células a combustível que funcionam de acordo com as reações químicas representadas:

Na reação global de funcionamento do bafômetro, os reagentes e os produtos desse tipo de célula são
- o álcool expirado como reagente; água, elétrons e H+ como produtos.
- o oxigênio do ar e H+ como reagentes; água e elétrons como produtos.
- apenas o oxigênio do ar como reagente; apenas os elétrons como produto.
- apenas o álcool expirado como reagente; água, C2H4O e H+ como produtos.
- o oxigênio do ar e o álcool expirado como reagentes; água e C2H4O como produtos.
03. (Enem PPL 2018) Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha. A reação não balanceada que ocorre é:
Ag2S (s) + Al(s) → Al2S3 (s) + Ag (s)
Dados da massa molar dos elementos (g mol-1): Ag = 108; S = 32.
UCKO, D. A. Química para as ciências da saúde: uma introdução à química geral, orgânica e biológica. São Paulo: Manole, 1995 (adaptado).
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
- 0,54 g.
- 1,08 g.
- 1,91 g.
- 2,16 g.
- 3,82 g.
04. (Enem PPL 2017) Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.

Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite mais CO2 é o
- etano.
- butano.
- metano.
- propano.
- acetileno.
05. (Enem 2010) As mobilizações para promover um planeta melhor para as futuras gerações são cada vez frequentes. A maior parte dos meios de transporte de massa é atualmente movida pela queima de um combustível fóssil. A título de exemplificação do ônus causado por essa prática, basta saber que um carro produz, em média, cerca de 200g de dióxido de carbono por km percorrido.
Revista Aquecimento Global. Ano 2, n° 8. Publicação do Instituto Brasileiro de Cultura Ltda.
Um dos principais constituintes da gasolina é o octano (C8H18). Por meio da combustão do octano é possível a liberação da energia, permitindo que o carro entre em movimento. A equação que representa a reação química desse processo demonstra que
- no processo há liberação de oxigênio, sob a forma de O2.
- o coeficiente estequiométrico para a água é de 8 para 1 do octano.
- no processo há consumo de água, para que haja liberação de energia.
- o coeficiente estequiométrico para o oxigênio é de 12,5 para 1 do octano.
- o coeficiente estequiométrico para o gás carbônico é de 9 para 1 do octano.