Equilíbrio Químico
Lista de 12 exercícios de Química com gabarito sobre o tema Equilíbrio Químico com questões do Enem.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Equilíbrio Químico.
01. (Enem PPL 2023) Ácido nítrico é um importante reagente usado no preparo de nitrato de amônio, NH4NO3, um fertilizante nitrogenado. Industrialmente, o ácido nítrico é obtido a partir da reação da amônia com gás oxigênio, um processo que ocorre em três etapas, todas exotérmicas.
Etapa 1: 4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (l)
Etapa 2: 2 NO (g) + O2 (g) → 2 NO2 (g)
Etapa 3: 3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g)
Na primeira etapa, forma-se NO, o qual reage com mais oxigênio formando NO2, um óxido ácido, que reage com a água formando HNO3 e NO. O composto NO é, portanto, um subproduto da reação. É importante o seu reaproveitamento, senão ele pode ser liberado para o ambiente, onde reagirá com o oxigênio, formando NO2.
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman, 2006 (adaptado).
O procedimento que permite diminuir a quantidade formada do subproduto NO é aumentar a
- pressão de oxigênio, na etapa 1.
- concentração de NO2, na etapa 3.
- quantidade de amônia, na etapa 1.
- quantidade de oxigênio, na etapa 2.
- temperatura dos reagentes, na etapa 1.
02. (Enem 2025) Para a produção de titânio metálico ou dióxido de titânio puros, é necessário fazer a cloração do minério que contém dióxido de titânio, com o objetivo de separar esse óxido de outras substâncias presentes no minério. A principal reação química de cloração é representada por:
TiO2 (s) + 2 Cl2 (g) ⇄ TiCl4 (g) + O2 (g) ΔH = +175 kJ/mol
Depois da cloração, o tetracloreto de titânio é condensado e convertido, novamente, a dióxido de titânio.
Após o sistema atingir o equilíbrio químico, como a formação do TiCl4 pode ser favorecida?
- Aumentando a pressão total do sistema.
- Diminuindo a temperatura do sistema.
- Aumentando a pressão parcial de O2.
- Aumentando a pressão parcial de Cl2.
- Variando a quantidade de TiO2.
03. (Enem 2023) O vidro contendo alumínio em sua composição é um excelente material para acondicionar medicamentos e suplementos, porque pode ser esterilizado por aquecimento. No entanto, quando o medicamento ou suplemento contém substâncias que se ligam fortemente ao íon desse metal, a dissolução do alumínio é promovida em função do deslocamento do equilíbrio químico estabelecido entre a espécie imobilizada no vidro e a espécie em solução. Por essa razão, recomenda-se que suplementos de nutrição de recém-nascidos contendo gluconato de cálcio sejam acondicionados em embalagens plásticas, e não nesse tipo de vidro.
Atualização da recomendação da Sociedade Portuguesa de Neonatologia. Disponível em: www.spneonatologia.pt. Acesso em: 22 out. 2021 (adaptado).
Caso esse suplemento seja acondicionado em embalagem desse tipo de vidro, o risco de contaminação por alumínio será maior se o(a)
- vidro da frasco for translúcido.
- concentração de gluconato de cálcio for alta.
- frasco de vidro apresentar uma maior espessura.
- vidro for previamente esterilizado em altas temperaturas.
- reação do alumínio com gluconato de cálcio for endotérmica.
04. (Enem 2° Dia (Amarela) 2018) Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
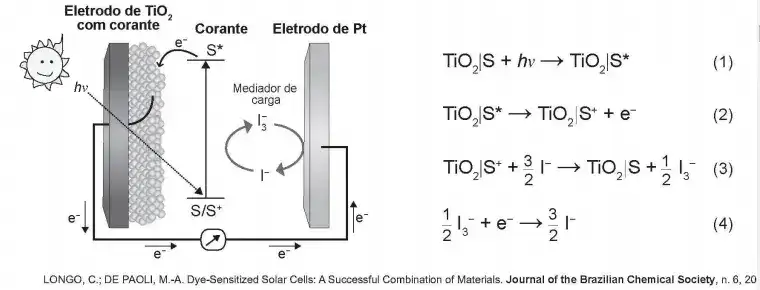
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
- reduz íons I– a I3–.
- regenera o corante.
- garante que a reação 4 ocorra.
- promove a oxidação do corante.
- transfere elétrons para o eletrodo de TiO2.
05. (Enem 1° Dia (Amarela) 2015) Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d'água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
(I) CaCO3(s) + CO2(g) + H2O (l) ⇌ Ca2+(aq) + 2 HCO3-(aq)
(II) HCO3-(aq) ⇌ H+(aq) + CO32-(aq) K1 = 3,0×10-11
(III) CaCO3(s) ⇌ Ca2+(aq) + CO32-(aq) K2 = 6,0×10-9
(IV) CO2(g) + H2O(l) ⇌ H+(aq) + HCO3-(aq) K3 = 2,5×10-7
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 °C, qual é o valor numérico da constante de equilíbrio da reação I?
- 4,5×10-26
- 5,0×10-5
- 0,8×10-9
- 0,2×105
- 2,2×1026
06. (Enem 2020) Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
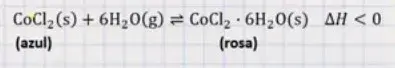
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
- Resfriaria no congelador.
- Borrifaria com spray de água.
- Envolveria com papel alumínio.
- Aqueceria com secador de cabelos.
- Embrulharia em guardanapo de papel.
07. (Enem PPL 2014) A formação de estalactites depende da reversibilidade de uma reação química. O carbonato de cálcio (CaCO3) é encontrado em depósitos subterrâneos na forma de pedra calcária. Quando um volume de água rica em CO2 dissolvido infiltra-se no calcário, o minério dissolve-se formando íons Ca2+ e HCO3-. Numa segunda etapa, a solução aquosa desses íons chega a uma caverna e ocorre a reação inversa, promovendo a liberação de CO2 e a deposição de CaCO3 de acordo com a equação apresentada.

Considerando o equilíbrio que ocorre na segunda etapa, a formação de carbonato será favorecida pelo(a)
- diminuição da concentração de íons OH- no meio.
- aumento da pressão do ar no interior da caverna.
- diminuição da concentração de HCO3- no meio.
- aumento da temperatura no interior da caverna.
- aumento da concentração de CO2 dissolvido.
08. (Enem 2015) Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d'água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
(I) CaCO3(s) + CO2(g) + H2O (l) ⇌ Ca2+(aq) + 2 HCO3-(aq)
(II) HCO3-(aq) ⇌ H+(aq) + CO32-(aq) K1 = 3,0×10-11
(III) CaCO3(s) ⇌ Ca2+(aq) + CO32-(aq) K2 = 6,0×10-9
(IV) CO2(g) + H2O(l) ⇌ H+(aq) + HCO3-(aq) K3 = 2,5×10-7
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 °C, qual é o valor numérico da constante de equilíbrio da reação I?
- 4,5×10-26
- 5,0×10-5
- 0,8×10-9
- 0,2×105
- 2,2×1026
09. (Enem PPL 2010) Às vezes, ao abrir um refrigerante, percebe-se que uma parte do produto vaza rapidamente pela extremidade do recipiente. A explicação para esse fato está relacionada à perturbação do equilíbrio químico existente entre alguns dos ingredientes do produto, de acordo com a equação:

A alteração do equilíbrio anterior, relacionada ao vazamento do refrigerante nas condições descritas, tem como consequência a
- liberação de CO2 para o ambiente.
- elevação da temperatura do recipiente.
- elevação da pressão interna no recipiente.
- elevação da concentração de CO2 no líquido.
- formação de uma quantidade significativa de H2O.
10. (Enem PPL 2013) À medida que se expira sobre uma solução de azul de bromotimol e hidróxido de sódio (NaOH), sua coloração azul característica vai se alterando. O azul de bromotimol é um indicador ácido-base que adquire cor azul em pH básico, verde em pH neutro e amarela em pH ácido. O gás carbônico (CO2) expirado reage com a água presente na solução (H2O), produzindo ácido carbônico (H2CO3). Este pode reagir com o NaOH da solução inicial, produzindo bicarbonato de sódio (NaHCO3):
CO2 + H2O → H2CO3
H2CO3 + NaOH → NaHCO3 + H20
ARROIO, A. et al. Química Nova na Escola, São Paulo, v. 29, 2006.
O que a pessoa irá observar à medida que expira no recipiente contendo essa solução?
- A solução mudará de cor, de azul para verde, e, em seguida, de verde para amarelo. Com o acréscimo de ácido carbônico, o pH da solução irá reduzir até tornar-se neutro. Em seguida, um excesso de ácido carbônico tornará o pH da solução ácido.
- A solução somente terá sua cor alterada de azul para amarelo, pois será formado um excesso de ácido carbônico no recipiente, o que reduzirá bruscamente o pH da solução.
- A cor da solução não será alterada com o acréscimo de ácido carbônico. Isso porque o meio é inicialmente neutro e a presença de ácido carbônico não produzirá nenhuma mudança no pH da solução.
- A solução mudará de azul para verde e, em seguida, de verde para azul. Isso ocorrerá em função da neutralização de um meio inicialmente básico acompanhado de um aumento de pH na solução, à medida que ácido carbônico é adicionado ao meio.
- A cor da solução alterará de azul para amarelo e, em seguida, de amarelo para verde. Esse comportamento é justificado pelo fato de o ácido carbônico reduzir bruscamente o pH da solução e depois ser neutralizado pelo restante de NaOH presente no meio.
11. (Enem 2024) A hidroxiapatita, Ca5(PO4)3OH, é um mineral constituinte do esmalte dos dentes. Entre as diversas reações que ocorrem no meio bucal, encontram-se em equilíbrio as reações de desmineralização e mineralização da hidroxiapatita em meio aquoso, ilustradas a seguir. A desmineralização está associada à fragilização do esmalte do dente e à formação de cáries.

O uso de creme dental pode minimizar a perda da hidroxiapatita. O quadro apresenta o agente de polimento e o pH de alguns cremes dentais comerciais.

STORGATTO, G.A.; BRAIBANTE, M. E. F.: BRAIBANTE, H. A química na odontologia. Química Nova na Escola, V. 39, fev. 2017 (adaptado).
Considerando o equilíbrio químico envolvido, qual creme dental promove a maior desmineralização do esmalte do dente?
- I
- II
- III
- IV
- V
12. (Enem PPL 2023) Os agentes lacrimogêneos são espécies químicas capazes de provocar forte irritação das vias aéreas superiores e dos olhos. Até o final da década de 1960, a cloroacetofenona (CA) foi a substância mais utilizada com essa finalidade. Uma forma de descontaminar a pele exposta à CA consiste em lavá-la com uma solução aquosa de determinado sal, o qual reagirá com a CA, conforme a reação representada

Qual destes compostos pode ser usado para fazer essa descontaminação?
- NaCH3COO
- NaHCO3
- NaHSO3
- Na2SO4
- NaOH