Química Geral II
Lista de 15 exercícios de Química com gabarito sobre o tema Química Geral II com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química Geral II.
01. (CN) Considere os seguintes métodos de separação de misturas.
I - Método com base na densidade.
II - Método com base no tamanho das partículas.
III - Método com base nas temperaturas de ebulição.
As definições acima se referem, respectivamente, a:
- I - decantação; II - peneiração; III - destilação
- I - flotação; II - destilação; III - decantação.
- I - filtração; II - catação; III - destilação.
- I - flotação; II - tamização; III - sublimação.
- I - decantação; II - destilação; III - filtração.
02. (EsPCEx) Analise as afirmações I, II, III e IV abaixo referente(s) à(s) característica(s) e/ou informação(ões) sobre algumas substâncias, nas condições ambientes:
I- A substância é a principal componente do sal de cozinha e pode ser obtida pela evaporação da água do mar. Dentre seus muitos usos podemos citar: a produção de soda cáustica e a conservação de carnes.
II- A substância é classificada como composta, e pode fazer parte da chuva ácida. Dentre seus muitos usos, podemos citar: utilização em baterias de automóveis e na produção de fertilizantes, como o sulfato de amônio.
III-A substância em solução aquosa é vendida em drogarias e utilizada como antisséptico e alvejante. Algumas pessoas utilizam essa substância para clarear pelos e cabelos.
IV-A substância é classificada como simples, tem seu ponto de ebulição igual a -195,8 0C, é a mais abundante no ar atmoférico e reage com o gás hidrogênio produzindo amônia.
As substâncias que correspondem às afirmações I, II, III e IV são, respectivamente,
- cloreto de sódio, ácido sulfúrico, permanganato de potássio, dióxido de enxofre
- cloreto de sódio,ácido clorídrico, peróxido de hidrogênio, dióxido de carbono
- cloreto de sódio, ácido muriático, óxido férrico, gás oxigênio
- cloreto de sódio, ácido sulfúrico, peróxido de hidrogênio, gás nitrogênio
- sulfato de alumínio, ácido muriático, óxido ferroso, gás nitrogênio
03. (EPCAR) Um líquido L1 de densidade 800 g/l será misturado a um líquido L2 de densidade 900 g/l Tal mistura será homogênea e terá a proporção de 3 partes de L1 para cada 5 partes de L2 A densidade da mistura final, em g/l, será
- 861,5
- 862
- 862,5
- 863
04. (EsPCEx) Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm · L · mol-1 · K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é: Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
- I, II e III.
- II e III.
- III e IV.
- II e IV.
- II, III e IV.
05. (EAM) De modo geral, os compostos que têm ligações covalentes:
- são formados pela ligação entre metais e o hidrogênio.
- são encontrados na natureza somente nos estados líquido e gasoso.
- são constituldos de átomos com tendência exclusiva em doar elétrons.
- formam estruturas eletricamente neutras denominadas moléculas.
- apresentam alta condutividade elétrica em todos os estados físicos.
06. (EsPCEx) “O tungstênio é encontrado em vários minerais, como óxidos de volframita – (Fe, Mn) WO4, e a scheelita – CaWO4. É usado em filamentos de lâmpadas incandescentes, em tanques de guerra, balas de revólver e em ferramentas de corte e perfuração”.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 207.
Acerca da espécie química CaWO4 e seus átomos constituintes, são feitas as seguintes afirmativas:
I – No composto CaWO4 o número de oxidação (Nox) do tungstênio é +6.
II – O composto CaWO4 é considerado um peróxido.
III – O CaWO4 é uma substância que possui apenas ligações do tipo covalente.
IV – O tungstênio (Z=74) é um metal de transição externa (“elementos com configuração eletrônica terminando em ns2 (n-1)d1 até 10”).
FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 206. Das afirmativas feitas estão corretas apenas
- I e II.
- II e III.
- III e IV.
- I e IV.
- I, II e III.
07. (EsPCEx) Considere que a reação de cobre metálico com ácido nítrico diluído produz, nas CNTP, um volume gasoso de 181,6 L de óxido de nitrogênio II (NO), água e nitrato de cobre II.
Nesse caso, a soma dos coeficientes estequiométricos da equação corretamente balanceada dessa reação completa e a massa de cobre consumida são, respectivamente,
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L
- 18 e 1222 g.
- 20 e 768 g.
- 16 e 154 g.
- 20 e 650 g.
- 18 e 402 g.
08. (EAM) Um gás ideal sofre uma transformação isobárica cuja pressão é 10 N/m², alterando de volume de 2 m³ para 6 m³.
Sendo assim, assinale a opção que fornece o trabalho, em joules, realizado pelo gás sobre o ambiente.
- 10
- 20
- 30
- 40
- 50
09. (EsPCEx) Na ânsia pelo “elixir da longa vida”, por volta do século I, alquimistas descobriram acidentalmente a Pólvora, referenciada em textos de Alquimia pelos avisos quanto aos cuidados para não se misturarem certos materiais uns com os outros. A pólvora, mais conhecida desde o final do século XIX como pólvora negra, é uma mistura química que queima com rapidez. Foi extensamente utilizada como propelente em canhões e armas de fogo e atualmente ainda é empregada em artefatos pirotécnicos. Nitrato de potássio, enxofre e carvão (carbono) são os constituintes da pólvora negra. Sobre as espécies constituintes da pólvora negra afirma-se que
Dados:
Número Atômico: K = 19; N = 7; O = 8; S = 16; C = 6
I – o nitrato de potássio é classificado como uma base segundo a teoria de Arrhenius;
II – a 25 ºC e 1 atm a variedade alotrópica mais estável do carbono é a grafite e a do enxofre é a rômbica;
III – a fórmula do nitrato de potássio é KNO2 ;
IV – o enxofre é um metal radioativo que pertence à família 6A (16) da tabela periódica;
V – o átomo de carbono (6C) estabelece 4 ligações químicas e possui a variedade alotrópica diamante, substância natural de alta dureza;
Estão corretas apenas as afirmativas
- I e IV.
- II e V.
- III, IV e V.
- I, II e V.
- II, III e IV
10. (CN) Analise o gráfico de aquecimento de uma substância representado na figura abaixo.
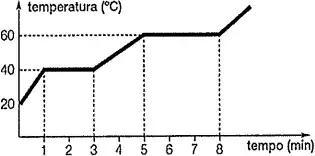
Sendo assim, é correto afirmar que:
- quando t = 2 minutos, tem-se um sistema bifásico.
- quando t = 4 minutos, coexistem substância sólida e substância líquida.
- quando t = 1 minuto, inicia-se a liquefação da substância.
- a substância tem ponto de fusão igual a 60ºC.
- no intervalo de 5 a 8 minutos, a substância encontra-se totalmente na forma de vapor.
11. (EsPCEx) Durante um experimento, um gás perfeito é comprimido, adiabaticamente, sendo realizado sobre ele um trabalho de 800 J. Em relação ao gás, ao final do processo, podemos afirmar que:
- o volume aumentou, a temperatura aumentou e a pressão aumentou.
- o volume diminuiu, a temperatura diminuiu e a pressão aumentou.
- o volume diminuiu, a temperatura aumentou e a pressão diminuiu.
- o volume diminuiu, a temperatura aumentou e a pressão aumentou.
- o volume aumentou, a temperatura aumentou e a pressão diminuiu.
12. (CN) De modo geral, os compostos que possuem ligações iônicas:
- são formados pela ligação entre ametais e o hidrogênio.
- são encontrados na natureza no estado líquido.
- apresentam baixos pontos de fusão e ebulição.
- são duros e resistentes a impactos.
- apresentam alta condutividade elétrica em solução aquosa.
13. (EsPCEx) No ano de 2014, os alunos da EsPCEx realizaram um experimento de eletrólise durante uma aula prática no Laboratório de Química. Nesse experimento, foi montado um banho eletrolítico, cujo objetivo era o depósito de cobre metálico sobre um clipe de papel, usando no banho eletrolítico uma solução aquosa 1 mol·L-1 de sulfato de cobre II. Nesse sistema de eletrólise, por meio de uma fonte externa, foi aplicada uma corrente constante de 100 mA, durante 5 minutos. Após esse tempo, a massa aproximada de cobre depositada sobre a superfície do clipe foi de:
Dados: massa molar Cu = 64 g/mol; 1 Faraday = 96500 C
- 2,401 g.
- 1,245 g.
- 0,987 g.
- 0,095 g.
- 0,010 g.
14. (EsPCEx) Compostos contendo enxofre estão presentes, em certo grau, em atmosferas naturais não poluídas, cuja origem pode ser: decomposição de matéria orgânica por bactérias, incêndio de florestas, gases vulcânicos etc. No entanto, em ambientes urbanos e industriais, como resultado da atividade humana, as concentrações desses compostos é alta. Dentre os compostos de enxofre, o dióxido de enxofre (SO2) é considerado o mais prejudicial à saúde, especialmente para pessoas com dificuldade respiratória.
(Adaptado de BROWN, T.L. et al, Química a Ciência Central. 9ª ed, Ed. Pearson, São Paulo, 2007)
Em relação ao composto SO2 e sua estrutura molecular, pode-se afirmar que se trata de um composto que apresenta
Dado: número atômico S = 16 ; O = 8
- ligações covalentes polares e estrutura com geometria espacial angular.
- ligações covalentes apolares e estrutura com geometria espacial linear.
- ligações iônicas polares e estrutura com geometria espacial trigonal plana.
- ligações covalentes apolares e estrutura com geometria espacial piramidal.
- ligações iônicas polares e estrutura com geometria espacial linear.
15. (EsPCEx) A representação a seguir corresponde à parte superior da tabela periódica, na qual as letras não correspondem aos verdadeiros símbolos dos elementos.
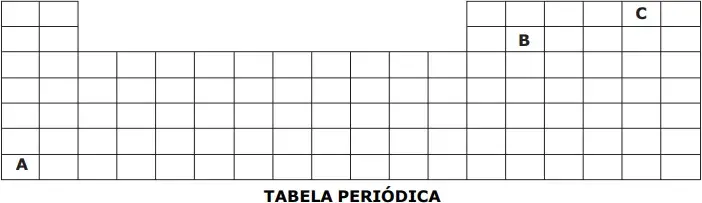
Considere as afirmativas acerca dos elementos hipotéticos (A, B, C) apresentados na Tabela Periódica.
I – Dentre os elementos hipotéticos, o elemento A é o de maior afinidade eletrônica (“energia liberada quando um átomo isolado, no estado gasoso, captura um elétron”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 202.
II – Dentre os elementos hipotéticos, pode-se afirmar que o elemento B é o de maior eletropositividade (“capacidade de um átomo perder elétrons, originando cátions”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 203.
III – Dentre os elementos hipotéticos, pode-se afirmar que o elemento C é o mais eletronegativo (“força de atração exercida sobre os elétrons de uma ligação”).
USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed. Reform - São Paulo: Ed. Saraiva, 2009, pág. 202.
Das afirmativas feitas está(ão) correta(s) apenas
- I.
- II.
- III.
- I e II.
- II e III.