Física-química
Lista de 15 exercícios de Química com gabarito sobre o tema Física-química com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Física-química.
01. (EEAR) Um montanhista, após escalar uma montanha e atingir certa altitude em relação ao nível do mar, resolveu utilizar um recipiente e um fogareiro para preparar seu chocolate quente. Percebeu que no topo da montanha sua bebida parecia não tão quente quanto aquela que preparava na praia. Sabendo que a temperatura de ebulição é diretamente proporcional à pressão externa ao líquido e considerando a constatação da temperatura feita pelo montanhista, pode-se afirmar que a pressão no topo da montanha em relação ao nível do mar, é:
- independente do local
- igual
- maior
- menor
02. (EN) Analise o diagrama PV abaixo.
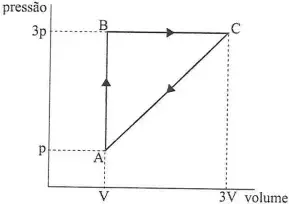
A figura acima exibe, num diagrama PV, um ciclo reversível a que está submetido 2 moles de um gás monoatômico ideal.
Sabendo que as temperaturas nos estados A, B e C estão relacionadas por TC = 3TB = 9TA, qual a eficiência do ciclo?
- 1/3
- 1/5
- 1/6
- 1/7
- 1/9
03. (EsPCEx) A gasolina é um combustível constituído por uma mistura de diversos compostos químicos, principalmente hidrocarbonetos. Estes compostos apresentam volatilidade elevada e geram facilmente vapores inflamáveis. Em um motor automotivo, a mistura de ar e vapores inflamáveis de gasolina é comprimida por um pistão dentro de um cilindro e posteriormente sofre ignição por uma centelha elétrica (faísca) produzida pela vela do motor.
Adaptado de: BROWN, Theodore; L. LEMAY, H Eugene; BURSTEN, Bruce E. Química a Ciência Central, 9ª edição, Editora Prentice-Hall, 2005, pág 926.
Pode-se afirmar que a centelha elétrica produzida pela vela do veículo neste evento tem a função química de
- catalisar a reação por meio da mudança na estrutura química dos produtos, saindo contudo recuperada intacta ao final do processo.
- propiciar o contato entre os reagentes gasolina e oxigênio do ar (O2), baixando a temperatura do sistema para ocorrência de reação química.
- fornecer a energia de ativação necessária para ocorrência da reação química de combustão.
- manter estável a estrutura dos hidrocarbonetos presentes na gasolina.
- permitir a abertura da válvula de admissão do pistão para entrada de ar no interior do motor.
04. (EN) O elemento químico Califórnio, Cf251, emite partículas alfa, se transformando no elemento Cúrio, Cm247. Essa desintegração obedece à função exponencial N(t) = N0e-at, onde N(t) é a quantidade de partículas de Cf251 no instante t em determinada amostra; N0 é a quantidade de partículas no instante inicial; e α é uma constante, chamada constante de desintegração.
Sabendo que em 898 anos a concentração de Cf251 é reduzida à metade, pode-se afirmar que o tempo necessário para que a quantidade de Cf251 seja apenas 25% da quantidade inicial está entre
- 500 e 1000 anos.
- 1000 e 1500 anos.
- 1500 e 2000 anos.
- 2000 e 2500 anos.
- 2500 e 3000 anos.
05. (EsPCEx) Reações conhecidas pelo nome de Termita são comumente utilizadas em granadas incendiárias para destruição de artefatos, como peças de morteiro, por atingir temperaturas altíssimas devido à intensa quantidade de calor liberada e por produzir ferro metálico na alma das peças, inutilizando-as. Uma reação de Termita muito comum envolve a mistura entre alumínio metálico e óxido de ferro III, na proporção adequada, e gera como produtos o ferro metálico e o óxido de alumínio, além de calor, conforme mostra a equação da reação:

Dados: Massas atômicas: Al = 27u; Fe = 56u e 0 = 16u
Entalpia PAdrão de formação:
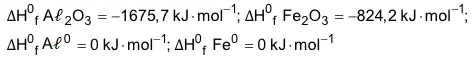
Considerando a equação de reação de Termita apresentada e os valores de entalpia (calor) padrão das substâncias componentes da mistura, a variação de entalpia da reação de Termita é
- ΔΗ0r=+2111,2 kJ
- ΔΗ0r=-1030,7 kJ
- ΔΗ0r=-851,5 kJ
- ΔΗ0r=-332,2 kJ
- ΔΗ0r=-1421,6 kJ
06. (CN) Considere os seguintes processos:
I- Atração do ferro pelo ímã.
II- Combustão da gasolina.
III- Desaparecimento de bolinhas de naftalina.
IV- Enferrujamento de um prego.
São processos químicos somente
- I e II.
- I e III.
- II e III.
- II e IV.
- III e IV.
07. (AFA) Considere um gás ideal que pode ser submetido a duas transformações cíclicas reversíveis e não simultâneas, 1 e 2, como mostrado no diagrama PV abaixo.
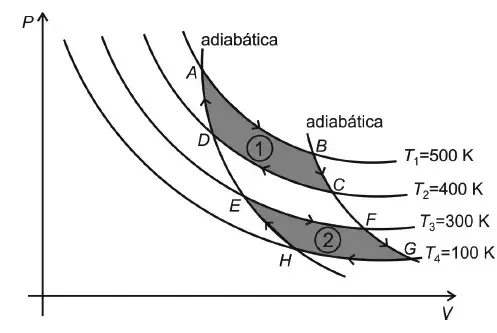
Na transformação 1 o gás recebe uma quantidade de calor Q1 de uma fonte quente à temperatura T1 e cede a quantidade de calor Q2 para a fonte fria à temperatura T2. Enquanto que, na transformação 2, as quantidades de calor recebida, Q’1, e cedida, Q’2, são trocadas respectivamente com duas fontes às temperaturas T3 e T4. Nessas condições, é correto afirmar que
- a variação da entropia nas transformações BC, DA, FG e HE é não nula.
- nas transformações AB e EF, a variação da entropia é negativa, enquanto que, nas transformações CD e GH, é positiva.
- na transformação 1, a variação da entropia é não nula e Q1 = Q2
- na transformação 2, a variação da entropia é nula e Q1’ = 3Q2’.
08. (EsPCEx) A água oxigenada ou solução aquosa de peróxido de hidrogênio (H2O2) é uma espécie bastante utilizada no dia a dia na desinfecção de lentes de contato e ferimentos. A sua decomposição produz oxigênio gasoso e pode ser acelerada por alguns fatores como o incremento da temperatura e a adição de catalisadores. Um estudo experimental da cinética da reação de decomposição da água oxigenada foi realizado alterando-se fatores como a temperatura e o emprego de catalisadores, seguindo as condições experimentais listadas na tabela a seguir:
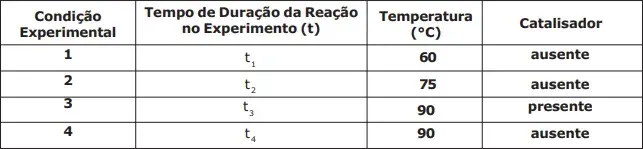
Analisando os dados fornecidos, assinale a alternativa correta que indica a ordem crescente dos tempos de duração dos experimentos.
- t1 < t2 < t3 < t4
- t3 < t4 < t2 < t1
- t3 < t2 < t1 < t4
- t4 < t2 < t3 < t1
- t1 < t3 < t4 < t2
09. (EsPCEx) A uma solução aquosa de 100 mL de ácido clorídrico (HCl) de concentração 1 mol·L-1 foram adicionados 400 mL de uma solução aquosa de hidróxido de sódio (NaOH) de concentração 0,75 mol·L-1.
Considerando que:
- a solução básica foi parcialmente neutralizada pela solução do ácido;
- o ácido clorídrico é um ácido forte (α=100%);
- o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60
- 13,6.
- 11,4.
- 9,8.
- 7,5.
- 4,3.
10. (EsPCEx) Considere, no quadro abaixo, as seguintes entalpias de combustão nas condições-padrão (25 °C e 1 atm), expressas em kJ · mol-1.
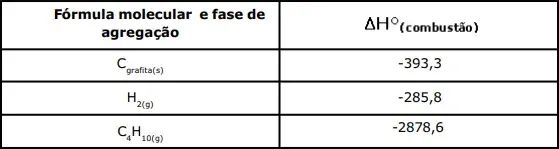
A alternativa que corresponde ao valor da entalpia da reação abaixo, nas condições-padrão, é:
4 C(grafita)(s) + 5 H2(g) → C4H10(g)
- +68,6 kJ·mol-1
- -123,6 kJ·mol-1
- +248,8 kJ·mol-1
- +174,4 kJ·mol-1
- -352,5 kJ·mol-1
11. (EsPCEx) No ano de 2018, os alunos da EsPCEx realizaram, na aula prática de laboratório de química, um estudo sobre revestimento de materiais por meio da eletrólise com eletrodos ativos, visando ao aprendizado de métodos de proteção contra corrosão. Nesse estudo, eles efetuaram, numa cuba eletrolítica, o cobreamento de um prego, utilizando uma solução de sulfato de cobre II e um fio de cobre puro como contra-eletrodo. Para isso, utilizaram uma bateria como fonte externa de energia, com uma corrente contínua de intensidade constante de 100 mA e gastaram o tempo de 2 minutos. Considerando-se não haver interferências no experimento, a massa aproximada de cobre metálico depositada sobre o prego foi de
Dados: massa molar do cobre = 64 g · mol-1; 1 Faraday = 96500 C · mol-1
- 6,50 mg.
- 0,14 mg.
- 20,42 mg.
- 12,01 mg.
- 3,98 mg.
12. (EsPCEx) Uma solução aquosa, à temperatura de 25°C, apresenta um potencial hidrogeniônico (pH) igual a 6 (seis). A concentração em mol · L-1 de íons OH1-, e seu potencial hidroxiliônico (pOH) nesta solução são, respectivamente:
Dados: Kw = 10-14 (mol · L-1)2
- 10-6, 8
- 10-8, 8
- 10-7, 7
- 10-5, 9
- 10-10, 4
13. (EsPCEx) A reação de combustão completa do etanol (C2H5OH) produz gás carbônico (CO2) e água (H2O). Dada a tabela abaixo, de calores de formação das espécies químicas, e considerando a reação de combustão completa desse álcool, são feitas as seguintes afirmativas:
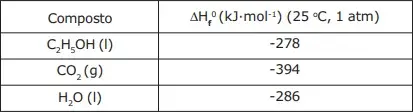
I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
- II, III, e IV.
- I e II.
- III e IV.
- II e IV.
- I e III.
14. (EsPCEx) Em condições adequadas, a água vaporiza-se, passando do estado líquido para vapor. Considerando o processo de vaporização da água, nas condições fornecidas:
H2O(l) → H2O(v) ᐃH = + 44 kJ/mol
A quantidade de calor necessária para provocar a vaporização de 900 mL de água líquida nesse processo é:
Dados:
Densidade da água = 1,0 g/mL
Massas atômicas : H=1 u; O=16 u
- 3000 kJ
- 1500 kJ
- 2200 kJ
- 2000 kJ
- 1800 kJ
15. (EsPCEx) Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio como o NO, N2O e o NO2 (denominados NOx) em gás nitrogênio (N2) e gás oxigênio (O2). Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
I - a decomposição catalítica de óxidos de nitrogênio produzindo o gás oxigênio e o gás nitrogênio é classificada como uma reação de oxidorredução;
II – o CO2 é um óxido ácido que, ao reagir com água, forma o ácido carbônico;
III – catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação;
IV – o CO é um óxido básico que, ao reagir com água, forma uma base;
V – a molécula do gás carbônico (CO2) apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas a
- I e II.
- II e V.
- III e IV.
- I, III e V.
- II, IV e V.