Atomística (EsPCEx)
Lista de 11 exercícios de Química com gabarito sobre o tema Atomística (EsPCEx) com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Atomística (EsPCEx).
01. (EsPCEx 2009) Considere as seguintes afirmações:
I O último nível de energia de um átomo, cujo número quântico é igual a 4, pode ter, no máximo, 32 elétrons.
II No estado fundamental, o átomo de fósforo possui três elétrons desemparelhados.
III O átomo de nitrogênio é mais eletronegativo que o átomo de flúor.
IV A primeira energia de ionização do átomo de nitrogênio é menor que a primeira energia de ionização do átomo de fósforo.
V A configuração eletrônica 1s2 2s1 2px1 2py1 2pz1, representa um estado ativado (ou excitado) do átomo de carbono.
Das afirmações feitas. Estão corretas:
| Dados | ||||
|---|---|---|---|---|
| Elemento Químico | C (Carbono) | F (Flúor) | P (Fósforo) | N (nitrogênio) |
| Número Atômico | Z=6 | Z=9 | Z=15 | Z=7 |
- Apenas I, II, IV, V
- Apenas III, IV, V
- Apenas I, II, V
- Apenas IV, V
- todas
02. (EsPCEx) Segundo o modelo atômico de Ernest Rutherford ou “modelo atômico orbital”, o átomo é formado em grande parte por espaços vazios, constituídos por partículas eletricamente carregadas de naturezas diferentes. A esta natureza elétrica convencionou-se denominar de carga positiva e carga negativa, para o próton e para o elétron, respectivamente. Rutherford também obteve dados experimentais que demonstram que:
1. Toda massa do átomos estava concentrada no seu interior, ou seja, no núcleo do átomo;
2. A massa dos elétrons é aproximadamente 1840 vezes menor que a massa do próton.
Com base no texto pode-se afirmar que se fosse possível acrescentar elétrons indefinidamente ao átomo de urânio (Z = 92 e massa atômica = 238 u), seriam necessários, para aumentar em 1% a massa atômica deste elemento, aproximadamente:
- 1692 elétrons
- 2342 elétrons
- 1234 elétrons
- 4379 elétrons
03. (EsPCEx 2016) Munições traçantes são aquelas que possuem um projétil especial, contendo uma carga pirotécnica em sua retaguarda. Essa carga pirotécnica, após o tiro, é ignificada, gerando um traço de luz colorido, permitindo a visualização de tiros noturnos a olho nu. Essa carga pirotécnica é uma mistura química que pode possuir, dentre vários ingredientes, sais cujos íons emitem radiação de cor característica associada ao traço luminoso.
Um tipo de munição traçante usada por um exército possui na sua composição química uma determinada substância, cuja espécie química ocasiona um traço de cor correspondente bastante característico. Com relação à espécie química componente da munição desse exército sabe-se:
I. A representação do elemento químico do átomo da espécie responsável pela coloração pertence à família dos metais alcalinos-terrosos da tabela periódica.
II. O átomo da espécie responsável pela coloração do traço possui massa de 137 u e número de nêutrons 81. Sabe-se também que uma das espécies apresentadas na tabela do item III (que mostra a relação de cor emitida característica conforme a espécie química e sua distribuição eletrônica) é a responsável pela cor do traço da munição desse exército.
III. Tabela com espécies químicas, suas distribuições eletrônicas e colorações características:
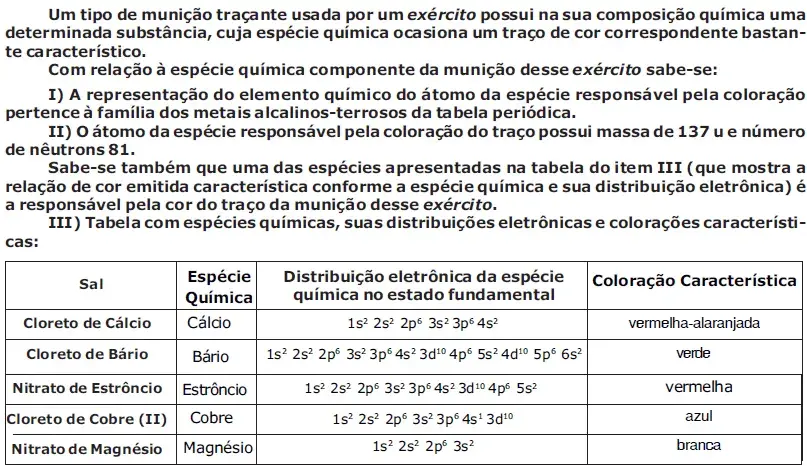
Considerando os dados contidos, nos itens I e II, atrelados às informações da tabela do item III, a munição traçante, descrita acima, empregada por esse exército possui traço de coloração
- vermelho-alaranjada.
- verde.
- vermelha.
- azul.
- branca
04. (EsPCEx 2010) Considere as seguintes informações, referentes à evolução dos modelos atômicos:
I- No modelo de Dalton, o átomo é dividido em prótons e elétrons;
II- No modelo de Rutherford, os átomos são constituídos por um núcleo muito pequeno e denso e carregado positivamente. Ao redor do núcleo estão distribuídos os elétrons, como planetas em torno do Sol.
III- O físico inglês Thomson afirma, em seu modelo atômico, que um elétron, ao passar de uma órbita para outra, absorve ou emite um quantum (fóton) de energia.
Das afirmações feitas, está(ão) correta(s):
- Apenas III
- Apenas I e II
- Apenas II e III
- Apenas II
- todas
05. (EsPCEx) Muitos dos processos metalúrgicos atuais tem em sua base conhecimentos desenvolvidos há milhares de anos, como mostra o quadro:

Podemos observar que a extração e o uso de diferentes metais ocorreram a partir de diferentes épocas.
Uma das razões para que a extração e o uso do ferro tenham ocorrido após a do cobre ou a do estanho é:
- a inexistência do uso de fogo que permitisse sua moldagem.
- a necessidade de temperaturas mais elevadas para sua extração e moldagem.
- o desconhecimento de técnicas para a extração de metais a partir de minérios.
- a necessidade do uso do cobre na fabricação do ferro.
- seu emprego na cunhagem de moedas, em substituição ao ouro.
06. (EsPCEx 2016) Considere dois elementos químicos cujos átomos fornecem íons bivalentes isoeletrônicos, o cátion X²+ e o ânion Y²-. Pode-se afirmar que os elementos químicos dos átomos X e Y referem-se, respectivamente, a:
- 20Ca e 34Se
- 38Sr e 8O
- 38Sr e 16S
- 20Ca e 8O
- 20Ca e 16S
07. (EsPCEx 2012) A seguir são apresentadas as configurações eletrônicas, segundo o diagrama de Linus Pauling, nos seus estados fundamentais, dos átomos representados, respectivamente, pelos algarismos I, II, III e IV.
I. 1s² 2s² 2p6
II. 1s² 2s² 2p6 3s1
III. 1s² 2s² 2p6 3s²
IV. 1s² 2s² 2p6 3s² 3p5
Com base nessas informações, a alternativa correta é:
- O ganho de um elétron pelo átomo IV ocorre com absorção de energia.
- Dentre os átomos apresentados, o átomo I apresenta a menor energia de ionização.
- O átomo III tem maior raio atômico que o átomo II.
- O cátion monovalente oriundo do átomo II é isoeletrônico em relação ao átomo III.
- A ligação química entre o átomo II e o átomo IV é iônica.
08. (EsPCEx 2014) Um átomo neutro do elemento genérico A, ao perder 2 elétrons forma um cátion bivalente, contendo 36 elétrons. O número atômico deste átomo A é:
- 36
- 42
- 34
- 40
- 38
09. (EsPCEx 2011) A distribuição eletrônica do átomo de ferro (Fe), no estado fundamental, segundo o diagrama de Linus Pauling, em ordem energética, é 1s² 2s² 2p6 3s² 3p6 4s².
Sobre esse átomo, considere as seguintes afirmações:
I. O número atômico do ferro (Fe) é 26.
II. O nível/subnível 3p6 contém os elétrons mais energéticos do átomo de ferro (Fe), no estado fundamental.
III. O átomo de ferro (Fe), no nível/subnível 3d6, possui 3 elétrons desemparelhados, no estado fundamental.
IV. O átomo de ferro (Fe) possui 2 elétrons de valência no nível 4 (4s²), no estado fundamental.
Das afirmações feitas, está(ão) correta(s):
- apenas I.
- apenas II e III.
- apenas III e IV.
- apenas I, II e IV.
- todas.
10. (EsPCEx 2010) Considere as seguintes informações:
I. A configuração eletrônica, segundo o diagrama de Linus Pauling, do ânion trivalente de nitrogênio (7N-3). que se origina do átomo nitrogênio, é 1s² 1s² 2s6;.
II. Num mesmo átomo, não existem dois elétrons com os quatro números quânticos iguais.
III. O íon 1939K 1+ possui 19 nêutrons.
IV. Os íons Fe+2 e Fe+3 do elemento químico ferro diferem somente quanto ao número de prótons.
Das afirmações feitas, está(ão) correta(s)
- apenas I e II.
- apenas I, II e III.
- apenas IV.
- apenas III e IV.
- todas.
11. (EsPCEx 2011) Considere três átomos cujos símbolos são M, X e Z, e que estão nos seus estados fundamentais. Os átomos M e Z são isótopos, isto é, pertencem ao mesmo elemento químico; os átomos X e Z são isóbaros e os átomos M e X são isótonos. Sabendo que o átomo M tem 23 prótons e número de massa 45 e que o átomo Z tem 20 nêutrons, então os números quânticos do elétron mais energético do átomo X são: Observação: Adote a convenção de que o primeiro elétron a ocupar um orbital possui o número quântico de spin igual a spin =
- n = 3; l = 0; m= 2; s = -1/2
- n = 3; l = 2; m= 0; s = -1/2
- n = 3; l = 2; m= -2; s = -1/2
- n = 3; l = 2; m= -2; s = 1/2
- n = 4; l = 1; m= 0; s = -1/2